Leyes de los Gases
Las primeras leyes de los gases fueron desarrolladas desde
finales del siglo XVII, cuando los científicos empezaron a
darse cuenta de que en las relaciones entre la presión,
el volumen y
la temperatura de
una muestra de gas,
en un sistema cerrado, se podría obtener una fórmula
que sería válida para todos los gases. Estos se comportan de forma similar en
una amplia variedad de condiciones debido a la buena aproximación que tienen
las moléculas que se encuentran más separadas, y hoy en día la ecuación de
estado para un gas ideal se deriva de la teoría cinética. Ahora las leyes anteriores de
los gases se consideran como casos especiales de la ecuación del gas ideal, con
una o más de las variables constantes. Fósforo (P) del
griego phosphoros, ‘portador de luz’ (el fósforo emite luz
en la oscuridad porque arde al combinarse lentamente con el oxígeno del aire).
Ley
de Charles
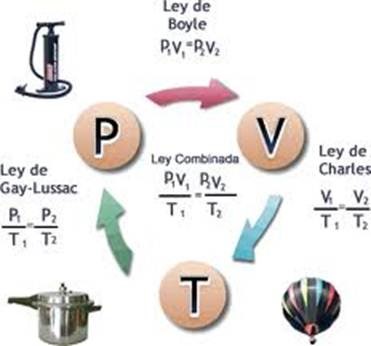
La ley de Charles, o ley de los
volúmenes, fue descubierta en 1778. Se dice que, para un gas ideal a presión
constante, el volumen es directamente proporcional a la temperatura absoluta (en kelvin).
Esto se puede encontrar utilizando
la teoría cinética de los gases o un
recipiente con calentamiento o enfriamiento [sin congelar <0] con un volumen
variable (por ejemplo, un frasco cónico con un globo).
Ley
de Gay-Lussac
Postula que las presiones ejercidas por
un gas sobre las paredes del recipiente que lo contienen son proporcionales a
sus temperaturas absolutas cuando el volumen es constante.
Combinación
y leyes de los gases ideales
Ley de Boyle establece que el producto presión-volumen es
constante.
Ley de
Gay-Lussac dice
que la presión es proporcional a la temperatura absoluta.
Vídeo 1: Ley de los Gases
Presentación 1: Ley de los gases Slideshare

No hay comentarios:
Publicar un comentario